一分鐘準備段考
- 清楚每個物理名詞的定義
- 公式不要死記,要能推導
- 整理比較,如摩擦力的特徵、牛頓運動定律等
- 利用名師學院系列產品,反覆觀看、補強弱點
|
有機化合物
一、有機化合物的定義
1. 早期指來自動物、植物等生命體的化合物。西元1828年烏勒(拉)從氰酸銨合成尿素,才修正其定義。
2. 現今定義指含有碳之化合物皆為有機化合物,除了一氧化碳(CO)、二氧化碳(CO2)、二硫化碳(CS2)、碳化鈣(CaC2)、氰酸鹽、氰化物、碳酸鹽等被視為無機化合物。
二、 官能基與同系物
1. 碳氫化合物的氫原子可被他種原子或原子團取代,這取代氫的原子或原子團稱為「官能基」。
2. 同系物:官能基相同,但分子是彼此相差 n 個(CH2)者。
三、鍵結原理
1. CnH2n+2:飽和、鏈狀,既無雙鍵、參鍵,亦無環。
2. CnH2n:較飽和鏈狀烴少 2 個H,必含 1 個雙鍵或 1 個環,如:C4H8、C6H12。
3. CnH2n-2:較飽和鏈狀烴少 4 個 H ,必含 1 個參鍵、 2 個雙鍵、 2 個環或 1 個雙鍵和 1 個環,如:C4H6、C5H8。
4. C6H5R:芳香烴至少比飽和鏈狀烴少 8 個 H
5. 其他:遇到鹵素均視同氫原子處理。
6. 若 C 的數為 n 個,則最高 H 數之判定:
(1) 含 X 者:將 X 視為 H,(H + X) 的數目最多為 (2n + 2) 個。
- C4H7Cl3:必為飽和、鏈狀。
- C7H12Br2:必含1雙鍵或1環。
(2) 含 O、S 者:最高氫數為 (2n + 2) 個。
- C2H6O2:必為飽和、鏈狀。
- C4H8O2:必含 1 雙鍵或 1 環。
(3) 含 N、P 者:最高氫數為 (2n + 2 + N、P數目) 個。
- C3H7N:必含 1 雙鍵或 1 環。
- C4H8N2:必含 1 參鍵或 2 雙鍵或 2 環或 1 雙 1 環。
7. 偶數律:
(1) 奇數族之元素必含偶數個。
(2) 偶數族元素之數目不必考慮。如:C 4H 3Cl、C 6H 10O 2S 2N、C 7H 5Br 2…均不能安定存在。
(3) 判斷符不符合鍵結原理,考慮以下二點:
四、烴可由結構及型態做細部的分類
五、命名方式
1. 俗名:碳數較少的烴類(總碳數在六以下),以正、異、新之系統做為其異構物的命名方式。
(1) 正(n-):鏈狀結構、無支鏈之烷類,命名時在前面加上「正」。
(2) 異(iso-或i-):為一個分支(其中一個甲基(-CH3)接在第二個碳上成為支鏈)的異構物,以「異」加上總碳數之烷烴命名。
(3) 新(neo):有兩個分支的結構,指最新發現的異構物或第三個異構物,目前僅限於新戊烷 (neo-pentane) 與新己烷 (neo-hexane)。
2. IUPAC 命名法:亦為學名。由國際純粹暨應用化學聯合會,簡稱為 IUPAC (International Union of Pure and Applied Chemistry)所規定。
(1) 烷烴 (alkane):分子中碳與碳間僅為單鍵結構,為飽和烴。
- 烷烴的最長直鏈若由十個以內的碳所組成,以天干數字命名,並於天干數字後加上「烷」;碳數若大於十,則用漢字數字命名。
- 烷分子少一個氫原子時,此原子團稱為「烷基」,通常以 R 作為通用代號。
- 烷基依鍵結環境可區分為:
- 一級碳(1°C):烷基周圍只接氫 (如:甲基) 或只接一個碳 (如:乙基、正丙基等。)
- 二級碳(2°C):烷基周圍鍵結一個氫和兩個碳 (如:異丙基、第二丁基等)。
- 三級碳(3°C):烷基周圍鍵結三個碳 (如:第三丁基)。
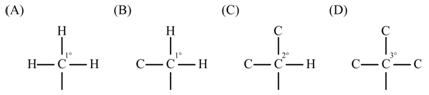
▲碳的級數:(A) 一級碳;(B) 一級碳;(C) 二級碳;(D) 三級碳
- 命名原則:
- 最長碳鏈為主鏈,主鏈需通過特性官能基。
- 主鏈上若有支鏈,則分別以甲基、乙基等順序標明取代基之種類及命名。(英文命名時,則以支鏈英文名稱的第一個英文字母順序排序)。
- 若主鏈上有取代基,則以最接近取代基的一端開始編號,並以阿拉伯數字標示取代基的位置,阿拉伯數字與取代基名稱間以「-」分隔。
- 當分子中有數個碳數相同的取代基時,則應選取代基較多且取代基的碳數較少者為主鏈。若相同的取代基不只一個,則先以2 、3、4 等來標示位置、以二、三、四等表示數量,且阿拉伯數字間以「,」分隔。命名時,先寫小的取代基,再寫大的取代基(如:先寫甲基位置,再寫乙基位置,依此類推)。
- 環烷烴命名:
- 在主鏈命名前加上「環」字。
- 若於環上有取代基,則從有取代基的碳開始編號命名。環烷烴雖為單鍵但不可自由旋轉,故可能產生幾何(順反)異構物,當取代基位於碳-碳鍵的同側為「順式異構物」,當取代基位於碳-碳鍵的異側時則為「反式異構物」。
- 環己烷為非平面結構,其幾何異構物一般常見有椅型 (chair) 與船型 (boat) 兩種,椅型結構較船型結構穩定。
(2) 烯烴 (alkene):分子內的碳與碳間含有雙鍵,為不飽和烴。
-
與烷烴命名方式相似,以最長的碳鍵為主鏈,主鏈需通過烯烴之官能基 (雙鍵),依主鏈之總碳數命名,並以最靠近雙鍵的碳為開端編號,若不止一個雙鍵則以二、三、四表示之。
- 主鏈上若有支鏈,則分別以甲基、乙基等順序標明取代基之種類及命名。
- 環烯烴之命名則在主鏈命名前加上「環」字,命名時先考慮雙鍵位置,再考慮取代基位置。
- 烯烴因含有雙鍵,故無法自由旋轉,當雙鍵兩端分別接有取代基時,則有幾何(順反)異構物產生,當取代基位於雙鍵的同側為「順式異構物」,當取代基位於雙鍵的異側時則為「反式異構物」。
(3) 炔烴 (alkyne):分子內的碳與碳間含有叁鍵,為不飽和烴。
- 命名基本上與烯烴相似,以最長的碳鍵為主鏈,且需通過炔烴之官能基,依主鏈之總碳數命名,如:乙炔 (HC≡CH)、丙炔 (HC≡CCH3)。
- 炔烴為參鍵,故無幾何異構物。環炔烴於碳數少時並不存在,較常見為環戊炔。
(4) 芳香烴 (aromatic hydrocarbons):
- 指具有未定域共振π電子的平面環狀化合物,且這些化合物具有相當的穩定性及有特殊氣味,故稱為芳香烴;一般係指分子中含有苯環結構者。
- 芳香烴及其衍生物的命名:
- 單取代基:苯環上的一個氫被一個取代基所取代。
- 雙取代基:苯環上的兩個氫分別被取代基所取代。依取代基的相關位置以鄰位 (o)、間位 (m)、對位 (p)或以數字1,2、1,3、1,4表示。
- 多取代基:苯環上的多個氫分別被取代基所取代,一般以數字表示取代基的位置。
- 多苯環化合物,如:聯苯、多氯聯苯、戴奧辛,或兩個以上的苯環相併,如:萘。
- 多苯環衍生物:主要依取代基的編號命名。
六、鹵烷 (HX)
1. 純的鹵烴是無色的、不溶於水、沸點和密度都大於相對應的烴。
2. 化學反應:脫除反應及取代反應 (親核基取代)。
七、醇 (ROH)
1. 易與水產生氫鍵、分子具有明顯的極性、沸點較其他分子量相同的有機化合物高。
2. 一級醇 (1ºROH) 可被氧化成醛或酸,二級醇 (2ºROH) 可被氧化成酮。三級醇 (3ºROH) 不可被氧化。
八、酚
酚:苯環上的氫被 OH 取代所成之化合物。
1. 俗稱石炭酸,為弱酸性,但不能使石蕊試紙變紅。
2. 由苯製酚:苯→鹵化→氯苯→取代中和→苯酚鈉→酸化→苯酚
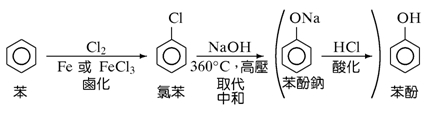
▲苯製酚
九、醚 (ROR')
醚 (ROR') :沸點較相對應分子量之醇為低,具有芳香味,極性小,不與水混合。
1. 命名法:不依總碳數,而依官能基左右之烷基命名。
2. 製備:醇類脫水或鹵烷之取代均可製醚。
十、醛 (RCHO) 和酮 (RCOR')
1. 分子具極性,但無分子間氫鍵,故分子量相近時,其沸點大小為:醇、醛、酮、醚、烴。
2. 醛可與斐林、本氏、多侖試劑反應而氧化成酸,酮則否。
十一、羧酸 (RCOOH)
1. 具有羧基,使得羧酸相較於醇類酸性與極性均較大、沸點高。
2. 具有分子間氫鍵,常形成二聚體。亦可與水形成氫鍵,低分子量的羧酸可與水以任何比例互溶。
十二、酯 (RCOOR')
1. 分子有極性,但無分子間氫鍵,沸點稍高於烴而低於醇及酸。
2. 酯類具揮發性及水果香,常用於製造香料。
十三、胺 (RNH2)
1. 可視為氨的衍生物,依氮上所接的烷基或芳香基的個數命名為第一胺、第二胺或第三胺。
2. 具高級性,第一、第二胺具分子間氫鍵,故沸點高於烴。氫鍵強度不夠強,故沸點低於醇。
3. 胺類具有特臭味。
十四、醯胺 (RCONH2)
醯胺(RCONH2):凡具有醯胺鍵結 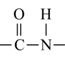 者均可視為醯胺類。
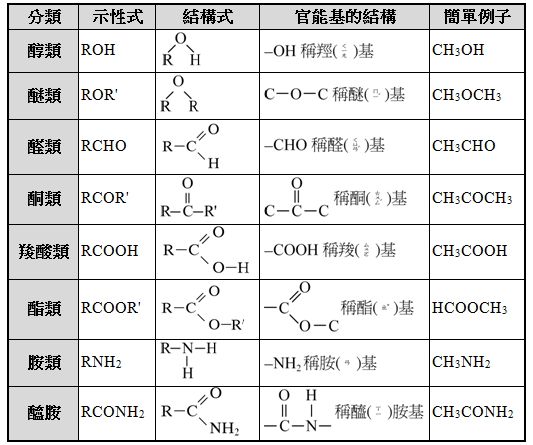
▲烴類衍生物一覽(R = C nH 2n+1)
十五、生物體內之有機物質
1. 醣類是碳、氫、氧化合物,通式為Cn(H2O)m,因此醣類又稱碳水化合物。如:C6H12O6、C12H22O11,但亦有例外。如:C5H10O4。
2. 蛋白質為天然的聚合物,由α−胺基酸聚合而成,具有酸性官能基及鹼性官能基。
3. 甘油酯指高級羧酸 (脂肪酸) 與丙三醇 (甘油)酯化所形成的酯類。而不飽和脂肪酸的甘油酯能與碘起化學反應,每一百公克油脂所能吸收碘的公克數即油脂的碘價,由碘價能知油脂所含不飽和脂肪酸的程度。
4. 核酸:分為核糖核酸 (RNA) 及去氧核糖核酸 (DNA) 兩類。並以核苷酸 (nucleotide) 為單體所組成的縮合聚合物。
5. 核苷酸單體中,含有五碳醣、含氮鹼基、磷酸等三個部分。

|




